皮肤黑色素瘤是一种高度恶性肿瘤, 由黑色素细胞病变形成, 常见于成人, 极少见于儿童. 近年来, 皮肤黑色素瘤的患病率呈现上升趋势, 已经成为严重的公共卫生问题[1]. 皮肤黑色素瘤的致死率较高且常发生转移, 因此早期诊断和治疗具有十分重要的意义.
皮肤黑色素瘤诊断方法包括ABCD法、七分列表法、三色法等[2], 通过观察颜色、形状、大小等主观规律判断在临床诊断中占主导地位. 早期病灶色素沉积较为均匀, 边界清晰且大多较小, 依靠规律诊断易造成误诊、漏诊.
随着计算机辅助医学图像分割技术的发展, 减少了因主观规律与经验造成的漏诊、误诊, 医学图像分割成为热门研究内容. Soler等人用阈值法分割肝脏和肿瘤区域, 通过对比图像灰度直方图确定病变强度[3]; Ben-Dan等人用直方图和统计分布函数及方差最小化方法分割图像的病变轮廓[4]; Dunn提出模糊C均值聚类, 通过计算像素点到聚类中心的加权灰度方差进行医学图像分割任务[5]. 虽然传统图像分割方法早期被广泛应用于医学图像分割, 但计算复杂, 需要依赖繁琐、准确的特征提取过程, 对专业知识的掌握要求高且难度过大, 因此传统医学图像分割方法近年来并未有显著的发展.
近年来, 卷积神经网络具有良好的泛化能力和特征提取能力, 能够准确分割不同大小、形状和位置的目标, 因此基于卷积神经网络的医学图像分割方法成为目前主流方法[6], 广泛应用于医学图像分割领域, 取得诸多研究成果. 如FCN网络模型[7]对图像进行像素级的分类, 从而解决了语义级别的图像分割问题; SegNet网络模型[8]采用编码解码结构, 编码部分在采样池化层中记录池化标记, 解码部分通过标记还原特征信息; UNet网络模型[9]采用编码解码及跳跃连接的拓扑结构, 能够实现在少量训练图像上进行更加精准的分割, 对医学图像特征提取具有较大帮助, 被广泛用在医学图像分割领域[10]. 但卷积神经网络在不断下采样的过程中会造成空间信息丢失, 对于分割任务来说, 每一处空间特征都十分重要, 且在各类分割任务中, 待分割目标大小、形状、位置都不尽相同, 仅靠传统的卷积神经网络方法不能够精确分割目标, 因此需要对卷积神经网络分割方法进行改进, 增强特征提取能力, 提高分割精度. 为扩大网络模型感受野, 提高多尺度提取特征能力, DeepLab V3网络模型[11]使用空洞卷积, 扩大了网络感受野, 适用于多尺度分割目标, 但大空洞率的并列卷积层会产生特征图栅格化, 造成病灶空间位置信息丢失; DeepLab V3+网络模型[12]在V3基础上引入编码解码结构, 解码部分采用4倍上采样的策略, 但大的采样倍数仍然不利于恢复空间特征信息; 为区分待分割区域与背景特征, Attention UNet网络模型[13]在深浅层特征融合之前引入Attention Gate对特征响应进行调整, 提高了待分割区域特征权重, 增强了网络模型对待分割区域特征提取能力, 但通道特征与空间特征同等重要, 需要突出有效通道特征表达. 在医学图像分割中, 待分割区域占图像比例通常较小, 造成网络模型提取待分割区域特征较弱, V-net提出Dice loss[14], 通过计算预测集合与真实集合的相似度对网络模型进行优化, 使网络模型对待分割区域的特征提取能力增强, 提高分割精度, 但病灶分割中, 每一个像素点特征都十分重要, 因此需要对像素点进行损失计算.
为解决上述分割方法中的不足, 本文提出一种改进MultiResUNet[15]的皮肤黑色素瘤图像分割方法MultiResUNet-SMIS, 创新点如下.
(1) 引入不同空洞率的空洞卷积替换普通卷积, 通过卷积层叠加的方式避免空洞卷积栅格化造成的空间信息丢失, 增大网络的感受野以多尺度提取病灶特征, 使网络模型能够分割不同大小、形状的病灶, 提高网络模型分割精度.
(2) 加入通道与空间双注意力模块att-Block, 在深浅层特征融合之前重新分配通道和空间权重, 增强相关空间和通道特征响应, 抑制无关特征, 提高分割精度.
(3) 提出一种新的损失函数FD loss, 结合Focal loss[16]像素层面计算回归损失的特点与Dice loss[14]在集合层面计算回归损失的特点, 从像素点到集合层面计算回归损失, 优化网络模型提取病灶特征能力, 进一步提高分割精准度.
1 MultiResUNet结构UNet是一种带有跳跃连接的编码解码结构卷积神经网络, 在提取和重建图像特征方面具有良好表现, 编码结构对输入图像进行卷积与下采样操作, 不断提取图像特征, 随着网络模型层数不断叠加, 图像分辨率越来越小. 解码结构对编码结构得到的低分辨率图像进行卷积与上采样操作, 将特征还原到与输入图像相同分辨率大小作为结果输出. 此外UNet通过跳跃连接, 将分辨率大小相同的编码解码特征拼接防止不断下采样造成的特征丢失.
MultiResUNet网络模型以UNet为基础. 该网络模型提出MultiRes Block模块取代UNet中堆叠的3×3卷积模块, 如图1所示. 该模块由3个大小为3×3的卷积层堆叠, 每个卷积层输出特征拼接后与残差路径输出特征相加. 卷积神经网络中, 通过卷积层堆叠可扩大感受野[16], 但随着卷积层数增多会增加更多可学习参数, 占用过多硬件资源. 因此模块中每个卷积层的通道数为该模块输出通道数的0.167、0.333、0.5, 在扩大感受野同时达到减少学习参数目的, 且该模块将对应层的输出通道数扩充为原通道数的1.67倍, 以提取更丰富的图像特征, 扩充后的通道数分别为[51, 105, 212, 426, 853].

|
图 1 MultiRes Block模块 |
同时, UNet结构深浅层特征差异较大, 编码解码结构相应层特征直接拼接导致空间信息丢失[17]. 因此MultiResUNet网络在跳跃连接处加入若干个残差模块[18]组成Res Path结构, 如图2, 用于缩小深浅层特征差异. 由于U型网络的特殊结构, 从上至下特征差异不断变小, 因此每层需要的残差模块个数也不同, 分别为[4, 3, 2, 1, 0].

|
图 2 Res Path结构 |
2 MultiResUNet-SMIS方法设计
皮肤黑色素瘤图像具有病灶大小、形状等各不相同的特点, 为更好地完成分割任务, 需要考虑从多方面提取特征. 本文针对原MultiResUNet网络模型中存在的感受野小的问题提出改进的空洞卷积dilation_MultiRes Block模块设计; 针对图像中干扰因素多的问题提出双注意力机制att-Block模块设计, 针对皮肤黑色素瘤图像前景背景区域大小失衡问题使用新设计的损失函数FD loss.
2.1 MultiResUNet-SMIS总体网络结构MultiResUNet-SMIS网络结构如图3, 整体结构包括编码路径和解码路径两个部分, 编码路径由改进的空洞卷积模块dilation_MultiRes Block和下采样模块Maxpool组成, 通过空洞卷积和下采样获取多尺度图像特征. 解码部分由dilation_MultiRes Block与上采样模块组成, 通过上采样恢复特征图的空间特征. 在编码与解码部分中间分别有数量不等的残差模块组成的Res Path, 旨在减少深浅层特征差异. 在深浅层特征拼接之前引入双注意力机制模块att-Block, 旨在重新分配特征权重, 突出感兴趣区域特征.
2.2 基于空洞卷积的dilation_MultiRes Block模块皮肤黑色素瘤病灶大小、形状不同, 需要扩大网络模型的感受野以多尺度提取病灶特征. 本文引入空洞率不同的空洞卷积替换原网络中的普通卷积, 通过空洞卷积层叠加的方式避免空间休息丢失, 有效提升网络模型感受野, 多尺度提取图像特征, 改进网络表现.
原MultiRes Block模块感受野大小为3×3、5×5、7×7, 但皮肤黑色素瘤图像的大小、形状、边缘复杂程度不同, 原结构的感受野大小并不能够有效提取全部图像特征, 需进一步提升感受野大小. 卷积神经网络中多次叠加卷积核能够扩大感受野, 但随着卷积核数量的增加, 模型需要学习的参数量也会增加, 容易出现过拟合问题. Yu 等人提出空洞卷积(dilation convolution)[19], 在不增加参数量的同时扩大感受野, 被广泛应用于密集预测任务[20]. 空洞卷积与普通卷积不同, 是带有空洞率的卷积, 空洞率为1时, 空洞卷积可以当作普通卷积, 当空洞率大于1时, 卷积核以空洞率减1进行间隔采样. Wang等人提出, 空洞卷积易造成网格化, 丢失重要特征信息[21], 因此空洞率的设定需要遵循一定的规律以避免丢失特征, 规律表达式为:
| $ {M_i} = \max \left\{ {{M_{i + 1}} - 2{r_i}, {M_{i + 1}} - 2\left( {{M_{i + 1}} - {r_i}} \right), {r_i}} \right\} $ | (1) |
表达式需要满足条件Mi = ri且M2 ≤ k, 其中k为卷积核大小. 例如当卷积核大小为3×3, 3个堆叠卷积核的空洞率为[1, 2, 5], M2 = 2符合规律, 不会丢失信息. 文中将3个叠加卷积核空洞率分别设为[1, 2, 5], 进而增大网络感受野, 改进的dilation_MultiRes Block结构如图4.

|
图 3 改进的MultiResUNet总体结构 |
根据感受野计算式(2), 其中lk–1为第k–1层感受野大小, fk为k层卷积核大小, si为卷积步距, 此时模块感受野大小为3×3、7×7、17×17, 在参数量一定的基础上有效扩增感受野且避免特征丢失, 使网络模型多尺度提取病灶特征.
| $ {l_k} = {l_{k - 1}} + \left[ {\left( {{f_k} - 1} \right) \times \prod\limits_{i = 1}^{k - 1} {{s_i}} } \right] $ | (2) |
皮肤黑色素瘤图像中病灶边界模糊, 对分割任务造成较大干扰, 传统的卷积神经网络分割方法不能准确预测模糊边缘病灶图像, 容易造成漏诊、误诊. 因此需要扩大病灶特征的特征响应, 抑制干扰特征表达. 文中提出一种双注意力机制att-Block, 通过重新分配空间特征权重与通道特征权重, 增强病灶特征响应以区分病灶与背景区域. 实验证明, 该方法能够减小病灶模糊边缘、气泡等因素对分割任务的干扰, 提高分割精度.

|
图 4 改进的MultiRes Block |
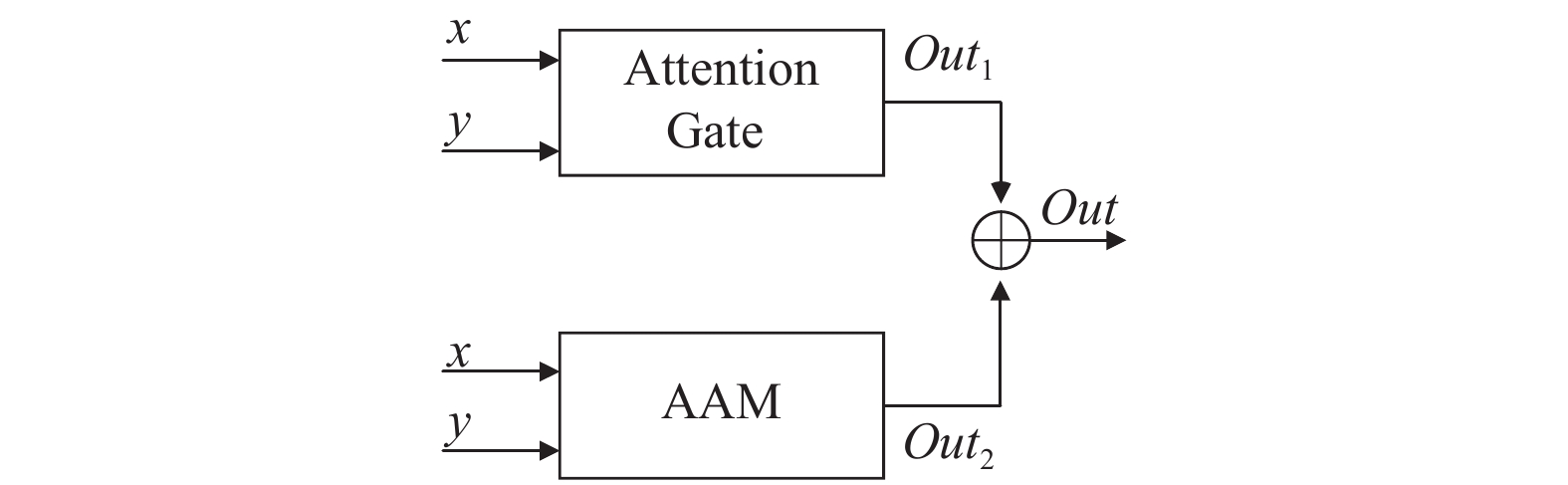
att-Block模块由空间注意力Attention Gate模块[13]与通道注意力AAM模块[22]组成, 在深浅层特征拼接之前重新分配特征权重, 增强感兴趣区域特征响应, 抑制无关特征表达.
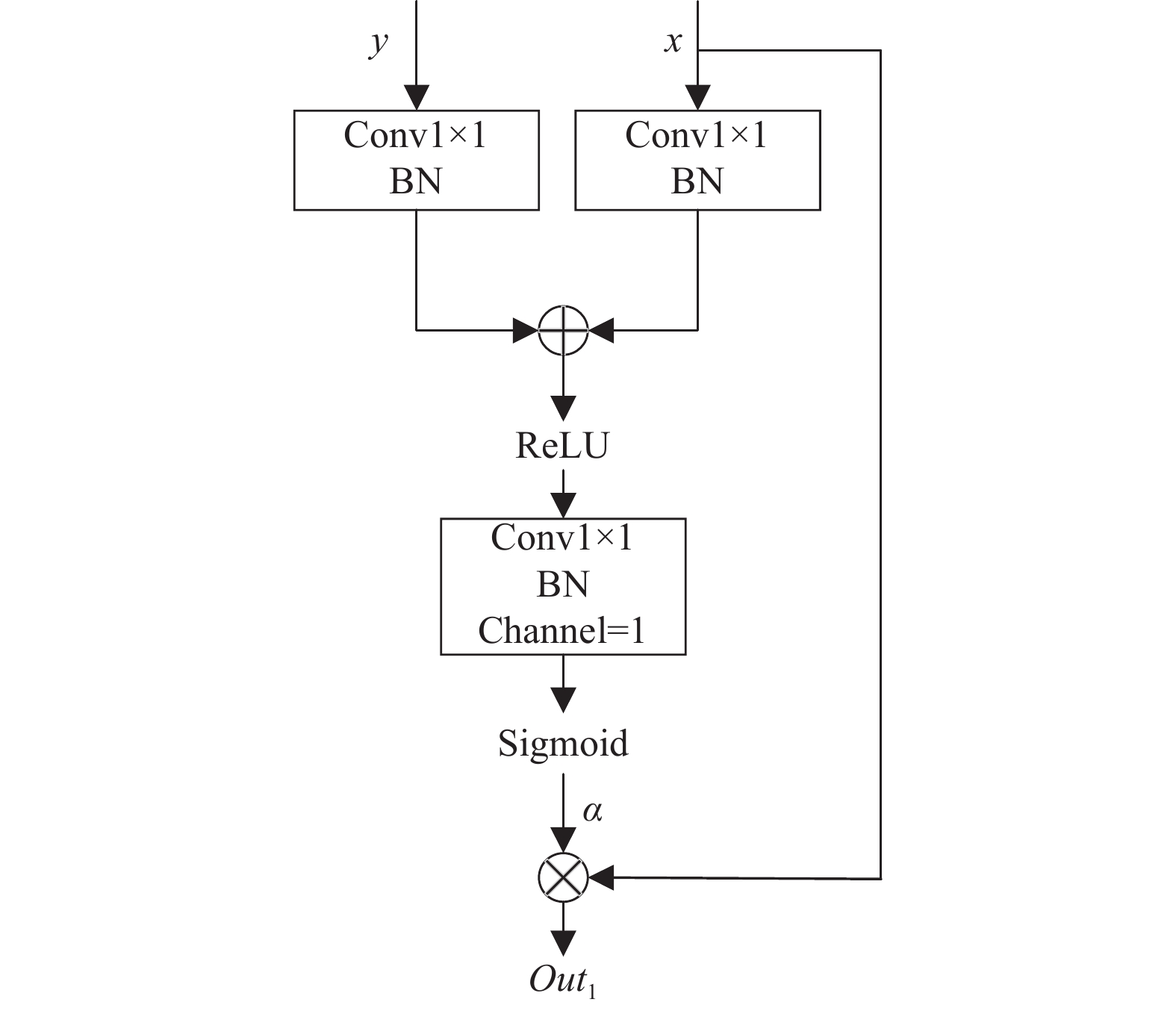
皮肤黑色素瘤图像中存在背景特征, 易对待分割区域产生干扰, 造成分割准确度不高, 因此需要加强待分割区域特征权重, 抑制背景特征表达以提高网络模型学习能力. Attention Gate能够识别显著图像区域, 对特征响应进行调整. 此结构利用语义较为丰富的深层特征对浅层特征进行引导, 通过深浅层特征融合对浅层特征逐像素产生权重系数以加强待分割区域特征响应, 且此模块适用于端到端训练, 通过反向传播不断更新权重系数, 使分割结果更精确. 模块如图5所示.
此模块有两个输入, 分别为深层特征y与浅层特征x. 特征y与特征x首先经过1×1卷积统一特征分辨率大小与通道数并求和, 之后对求和结果进行ReLU函数(式(3))激活并再次进行卷积, 将特征通道数压缩为1, 最后特征经过Sigmoid函数(式(4))激活得到注意力系数α, 过程表达式为:
| $ {\sigma _1}\left( x \right) = \max \left( {0, x} \right) $ | (3) |
| $ {\sigma _2}\left( x \right) = \frac{1}{{1 + {{\rm{e}}^{ - x}}}} $ | (4) |
| $ q\left( {x, y} \right) = \psi \left( {{\sigma _1}\left( {{W_x}x + {W_y}y + {b_g}} \right)} \right) + {b_\psi } $ | (5) |
| $ \alpha = {\sigma _2}\left( {q\left( {x, y} \right)} \right) $ | (6) |
其中, Wx与Wy为1×1卷积, bg与
|
图 5 Attention Gate结构 |
算法1. Attention Gate算法描述
输入: 深层特征y, 浅层特征x
输出: 加权待分割区域特征Out1
1) 通过卷积统一y、x分辨率与通道数得到Wxx与Wyy;
2) 将Wxx与Wyy进行求和;
3) 对求和结果进行ReLU函数激活;
4) 通过卷积将激活后的特征通道数压缩为1;
5) 将通道为1的特征图进行Sigmoid函数激活得到α;
6) 将浅层特征x逐像素与α相乘得到输出Out1.
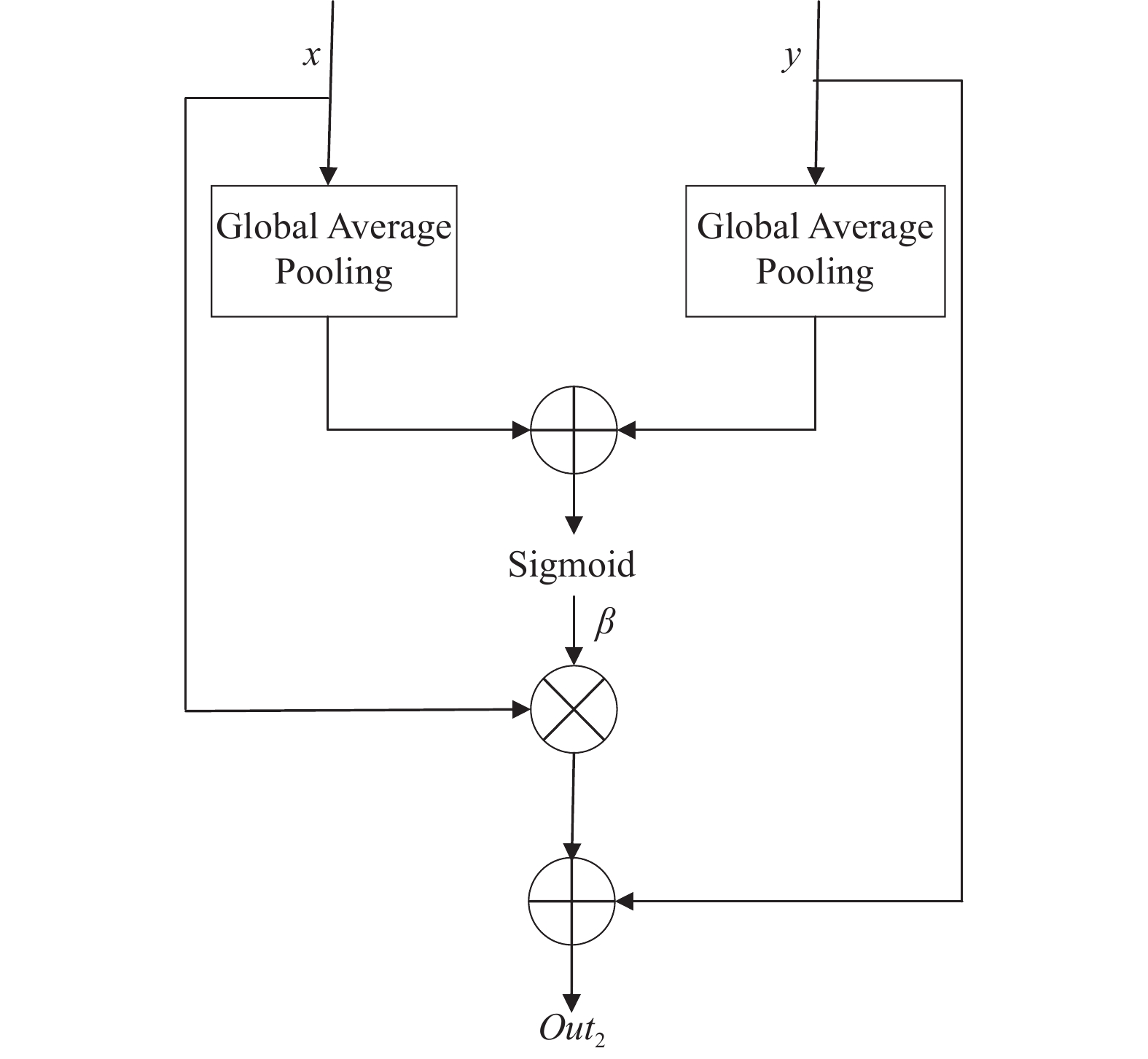
在卷积神经网络中, 不同通道包含图像不同的特征信息, 对通道进行选择使网络注意对分割有用的信息. AAM结构对通道进行过滤, 用语义信息更丰富的深层特征引导浅层特征, 对浅层通道特征重新分配权重以增强有关通道特征响应, 训练过程中通过反向传播不断更新权重系数, 逐步提升分割精度, 此模块也适用于端到端训练.
AAM模块如图6所示, x、y分别为浅层与深层特征. x、y首先经过全局平均池化将特征图分辨率调为1, 得到g(x)与g(y)后经ReLU函数(式(3))激活并求和, 经Sigmoid函数(式(4))激活得到通道注意力系数β, 过程表达式为:
| $ \beta = {\sigma _2}\left( {{\sigma _1}\left( {g\left( x \right)} \right) + {\sigma _1}\left( {g\left( y \right)} \right)} \right) $ | (7) |
其中, g(x)与g(y)为全局平均池化, 之后将注意力系数β与浅层特征x相乘, 结果与深层特征y相加得到输出Out2, 方法过程描述如算法2.
|
图 6 AAM结构 |
算法2. AAM 算法描述
输入: 深层特征y, 浅层特征x
输出: 加权通道特征Out2
1) x, y经过全局平均池化得到全局特征g(x), g(y);
2) 将g(x), g(y)经过ReLU函数激活;
3) 对激活后的特征进行求和;
4) 将求和后的特征经过Sigmoid函数激活得到系数β;
5) 将x与β相乘后与y相加得到输出Out2.
深浅层特征分别输入Attention Gate模块与AAM模块得到输出Out1与Out2, 之后将两个输出进行相加, 得到重新分配权重后的特征Out, att-Block整体结构如图7所示.
|
图 7 att-Block结构 |
2.4 基于Focal loss与Dice loss的混合损失函数设计
皮肤黑色素瘤数据集中背景区域较前景区域大, 使得网络模型偏向于预测背景区域. 针对此问题, 本文基于Focal loss[16]与Dice loss[14]提出一种新的损失函数FD loss. Focal loss通过像素值接近程度计算损失, Dice loss通过集合相似度计算损失, 结合两个函数, 从局部和整体优化网络模型的损失计算以提高网络模型分割精度. FD loss定义为:
| $ FD loss = \alpha {l_{{\rm{Focal}}}} + \beta {l_{{{{\rm{Dice}}}}}} $ | (8) |
其中, lFocal为Focal loss函数, lDice为Dice loss函数, α、β分别为每个损失函数的系数, 且满足条件α+β=1.
Focal loss是一种在交叉熵损失函数基础上修改的损失函数, 表达式为:
| $ FL\left( {{p_t}} \right) = - {\alpha _t}{\left( {1 - {p_t}} \right)^y}\log \left( {{p_t}} \right) $ | (9) |
当像素预测准确时pt → 1, (1–pt)γ→0; 当像素预测不准确时1–pt → 1, (1–pt)γ→1, 即该函数对于预测不准确像素损失没有改变, 对于预测准确的像素损失变小, 相当于增大预测不准确的像素损失权重, 使网络模型专注于难分类像素. 文中, γ取值为2, αt取值0.25.
Dice是一种集合相似度度量指标, 通常用于计算两个样本的相似度, Dice系数的表达式为:
| $ Dice = \frac{{2\displaystyle\sum\limits_i^N {{p_i}{g_i}} }}{{\displaystyle\sum\limits_i^N {p_i^2 + \displaystyle\sum\limits_i^N {g_i^2} } }} $ | (10) |
其中, pigi为预测分割图与标签之间的点乘相加运算, 在医学图像分割中, 分割图只有0, 1两个值, 因此pigi将存在于预测分割图而未在标签中的所有像素清零, 以惩罚低置信度的预测. Dice loss表达式为:
| $ Dice loss = 1 - Dice $ | (11) |
实验所用数据集为公开数据集ISIC-2018, 该数据集从ISIC-2017数据集[23]以及HAM10000数据集[24]中提取, 包含2 594张不同种类的皮肤黑色素瘤图像以及图像对应的标注文件. 实验中将数据集以比例8:2随机划分为训练集与验证集, 其中训练集有2 076张图像, 验证集有518张图像. 为方便图像输入图像并进行训练与验证, 预处理部分将原图像与标注图像尺寸统一为256×192, 并将原图像像素值除255统一到[0, 1]区间. 图8所示为皮肤黑色素瘤图像和标注图像, 待分割区域阈值为1, 对应图8(b)白色部分, 背景区域阈值为0, 对应图8(b)黑色部分.

|
图 8 皮肤黑色素瘤图像及标注 |
3.2 实验参数与评价指标
实验软硬件环境为: Ubuntu 16.04 LTS; 内存64 GB; GPU型号NVIDIA GeForce GTX 2080TI; CPU型号Intel Xeon CPU E5-2650; Python版本3.8.5; CUDA版本10.1; PyTorch版本1.8.0. 在实验中设置的初始学习率为0.001, 当Dice评价指标不再上升时学习率衰减为0.1倍, 优化器为Adam; batchsize为8, 总训练次数为100轮.
本文采用Dice相似度(Dice similariy coefficient, Dice)、交并比(intersection over union, IoU)、准确率 (accuracy, Acc)作为性能评价指标, 表达式如式(10)、式(12)、式(13); 用Params作为网络复杂度指标. 其中Dice用来衡量预测与真实区域之间的相似度, 在语义分割中常用做训练与评估, 文中作为主要性能评价参考指标.
| $ IoU = \frac{{\left| {A \cap B} \right|}}{{\left| {A \cup B} \right|}} $ | (12) |
其中, A为预测、B为标注,
| $ Acc = \frac{{TP + TN}}{{TP + TN + FP + FN}} $ | (13) |
其中, TP、TN、FP、FN分别为真阳性、真阴性、假阳性和假阴性, 分别代表分割正确的病灶像素、分割正确的非病灶像素、分割错误的病灶像素和分割错误的非病灶像素.
3.3 实验结果与分析为充分探究与分析本文提出的改进算法对皮肤黑色素瘤图像分割的有效性, 对dilation_MultiRes Block模块、att-Block模块以及损失函数FD loss进行实验, 具体实验算法如算法3.
算法3. 实验过程
输入: 待分割图像及标注
输出: 分割图像及各项指标
1) e = 训练轮次; m = 训练图像数量; n = 验证图像数量; b = 批处理量
2) for i=1 to e do
3) for j=1 to m/b do
4) 训练网络:
5) 将训练图像批次输入网络训练获得预测分割图
6) 将预测分割图与标注进行对比计算网络损失
7) 根据损失计算梯度, 并更新网络参数
8) 验证网络:
9) 将n/b张图像输入训练好的网络得到预测分割图
10) 根据评价指标公式计算各项指标
11) end
12)end
3.3.1 消融实验为更好地拟合ISIC-2018数据集, 文中设置了一系列实验来确定不同α、β取值对网络性能的影响. 实验结果如表1所示, 结果表明, 当α取值为0.2、β取值为0.8时各项指标均高于其他实验. 皮肤黑色素瘤图像分割是一种逐像素二值分类任务, 图像中待分割区与背景比例失衡, 二分类交叉熵损失函数无法调整权重, 造成网络模型偏向预测背景区, 降低分割精准度. Focal loss通过逐像素加权计算损失, 在像素层面惩罚容易分类类别, 扩大待分割区域在损失计算中的比重, 而Dice loss通过集合计算损失, 融合两个函数, 能够在像素与集合层面计算损失, 提高分割准确度.
| 表 1 不同α、β取值实验结果对比 |
为了验证不同改进方法对实验结果的影响, 针对在网络中使用dilation_MultiRes Block、att-Block以及FD loss对网络的影响进行了实验, 各项指标如表2, 分割图如图9. 最终文中所提改进方法Dice指数、IoU指数、Acc指数结果分别为89.47%、82.67%、96.13%, 较改进前方法均有提升.
根据表2, 得出以下结论: 1)网络中使用空洞卷积模块dilation_MultiRes Block, 在参数量没有改变的情况下, Dice指数有小幅度提升, 表明多尺度特征提取能够有效提升分割性能; 2)在网络中使用注意力模块att-Block, Dice指数较未使用之前提高近1.5个百分点, 虽然参数量略微有所上升, 但可以显著提高网络性能, 表明注意力机制能有效提高分割效果; 3)在网络中同时使用两个改进模块Dice指数较使用单个模块有小幅提升, 表明两个模块共同作用下效果好于单个模块使用; 4)在网络训练中使用FD loss损失函数Dice指数较使用BCE loss损失函数有小幅提升, 表明该损失函数能够更好处理数据集中存在的前景背景不均衡问题.
| 表 2 不同模块实验结果的比较 |

|
图 9 消融实验分割结果 |
图9为引入空洞卷积、att-Block模块以及在回归损失计算中采用FD loss的分割效果图. 图9(c)与图9(d)为分别在网络模型中引入空洞卷积与att-Block的分割结果图, 可直观观察到空洞卷积可一定程度上避免网络模型将背景区域误分为病灶区域, 但同时并不能完全分割整个病灶区域, att-Block模块可帮助网络模型分割全部病灶区域, 但在边界模糊区域分割结果并不精确, 仍存在背景区域误分为病灶的情况; 图9(e)为在网络模型中同时引入空洞卷积与att-Block模块, 此时分割结果图较图9(b) GT相似度较高, 且对于边界模糊区域分割更为精准; 图9(f)为MultiResUNet-SMIS分割方法, 能够直观看出分割图较GT最相似, 对于背景区域的模糊边界、气泡等干扰因素的过滤能力较强, 能够较为准确区分待分割区域与背景区域.
3.3.2 对比实验在ISIC-2018数据集上将UNet[9]、DeepLab V3+[12]、UNet++[25]、Attention UNet[13]、MultiResUNet作为对比方法进行实验, 结果如表3. MultiResUNet-SMIS取得了最优的分割性能, Dice、IoU、Acc指标分别达到89.47%、82.67%、96.13%, 虽然增加了一定参数量(Params), 但Dice指标较其他方法均高出2–3个百分点.
| 表 3 不同方法实验结果对比 |
从表3可以看出MultiResUNet-SMIS分割方法较其他方法在Dice指数、IoU指数、Acc指数均为最佳, 与U型结构网络模型UNet、Attention UNet、UNet++相比, 虽参数量有所增加, 但Dice评价指标均有明显提高, 与网络模型DeepLab V3+相比, 在参数量大幅度下降的情况下Dice指数仍有明显提升.
实验结果表明, 对比于其他方法, MultiResUNet-SMIS能够多尺度提取特征, 保留边界信息, 同时在网络中引入双注意力机制, 通过更新模型参数, 相关特征权重不断变大, 网络模型偏向于提取病灶特征, 提高分割精度. 同时通过FD loss损失函数, 综合像素以及集合计算损失, 提升网络模型分割效果.
图10为不同方法分割结果展示, 图10(c) UNet、图10(e) UNet++没有对网络进行改进, 不能够提取图像模糊边界特征, 存在对病灶的过度分割, 将部分背景区域误判为病灶区域; 图10(d) DeepLab V3+对图像进行多尺度特征提取, 对模糊边界较为敏感, 能够提取到较多病灶边缘信息, 但存在分割不充分问题, 如将部分病灶区域误判为背景区域; 图10(f) Attention UNet通过注意力机制加强病灶特征表达, 能够提取到较为充足的病灶特征, 但对于模糊边界病灶分割效果仍然有待提高; 图10(g) MultiResUNet分割方法在病灶分割任务中表现欠佳, 不能准确地分割病灶形状; 图10(h) MultiResUNet-SMIS方法能够过滤掉模糊边缘病灶等干扰因素, 在大病灶分割中效果好于其他方法, 分割精度最高, 效果最好.

|
图 10 不同方法分割结果展示 |
4 结语
针对现有图像分割方法存在的皮肤黑色素瘤病灶分割精度不高的问题, 文中提出MultiResUNet-SMIS分割方法, 使用空洞卷积扩大感受野, 适用于多尺度分割任务; 引入双注意力机制att-Block扩大相关特征影响, 抑制无关特征表达, 提高分割精度; 提出适用于前景背景不均衡图像的分割损失函数FD loss, 通过融合Focal loss与Dice loss, 在像素层面与集合层面综合考虑损失计算, 提高分割模型性能表现. 对比实验结果表明, 文中提出方法较原方法在Dice指数、IoU指数及准确率评价指标均有较大提高. 但实验结果也表明, 改进方法分割精度仍有较大提升空间, 需要进一步改进. 除此外, 改进方法也可适用于彩色图像的二值分割任务, 如结肠息肉分割, 但应注意在分割任务中包含小目标时需调整空洞卷积率以适应分割任务, 也可将FD loss函数应用于前景与背景区域比例失衡的分割任务. 在未来研究中, 本文方法可进一步得到改进与优化, 提高复杂边缘图像分割精度.
| [1] |
林千里, 张文俊, 汪汇, 等. 皮肤黑色素瘤流行病学及防治研究进展. 中国医药导报, 2019, 16(3): 28-32. |
| [2] |
唐志铭, 傅宏阳, 荆梦晴, 等. 皮肤镜在皮肤肿瘤诊断中的应用. 皮肤病与性病, 2021, 43(3): 352-354, 361. DOI:10.3969/j.issn.1002-1310.2021.03.013 |
| [3] |
Soler L, Delingette H, Malandain G, et al. Fully automatic anatomical, pathological, and functional segmentation from CT scans for hepatic surgery. Computer Aided Surgery, 2001, 6(3): 131-142. DOI:10.3109/10929080109145999 |
| [4] |
Ben-Dan I, Shenhav E. Liver tumor segmentation in CT images using probabilistic methods. Proceedings of the 2008 Medical Image Computing and Computer Assisted Intervention Workshop. New York: MICCAI, 2008. 41–43.
|
| [5] |
Dunn JC. A fuzzy relative of the ISODATA process and its use in detecting compact well-separated clusters. Journal of Cybernetics, 1973, 3(3): 32-57. DOI:10.1080/01969727308546046 |
| [6] |
张鑫, 姚庆安, 赵健, 等. 全卷积神经网络图像语义分割方法综述. 计算机工程与应用, 2022, 58(8): 45-57. DOI:10.3778/j.issn.1002-8331.2109-0091 |
| [7] |
Noh H, Hong S, Han B. Learning deconvolution network for semantic segmentation. Proceedings of 2015 IEEE International Conference on Computer Vision. Santiago: IEEE, 2015. 1520–1528.
|
| [8] |
Badrinarayanan V, Kendall A, Cipolla R. SegNet: A deep convolutional encoder-decoder architecture for image segmentation. IEEE Transactions on Pattern Analysis and Machine Intelligence, 2017, 39(12): 2481-2495. DOI:10.1109/TPAMI.2016.2644615 |
| [9] |
Ronneberger O, Fischer P, Brox T. U-Net: Convolutional networks for biomedical image segmentation. Proceedings of the 18th International Conference on Medical Image Computing and Computer-Assisted Intervention. Munich: Springer, 2015. 234–241.
|
| [10] |
殷晓航, 王永才, 李德英. 基于U-Net结构改进的医学影像分割技术综述. 软件学报, 2021, 32(2): 519-550. DOI:10.13328/j.cnki.jos.006104 |
| [11] |
Chen LC, Papandreou G, Schroff F, et al. Rethinking atrous convolution for semantic image segmentation. arXiv:1706.05587, 2017.
|
| [12] |
Chen LC, Zhu YK, Papandreou G, et al. Encoder-decoder with atrous separable convolution for semantic image segmentation. Proceedings of the 15th European Conference on Computer Vision. Munich: Springer, 2018. 833–851.
|
| [13] |
Oktay O, Schlemper J, Le Folgoc L, et al. Attention U-Net: Learning where to look for the pancreas. arXiv:1804.03999, 2018.
|
| [14] |
Milletari F, Navab N, Ahmadi SA. V-Net: Fully convolutional neural networks for volumetric medical image segmentation. Proceedings of the 4th International Conference on 3D Vision. Stanford: IEEE, 2016. 565–571.
|
| [15] |
Ibtehaz N, Rahman MS. MultiResUNet: Rethinking the U-Net architecture for multimodal biomedical image segmentation. Neural Networks, 2020, 121: 74-87. DOI:10.1016/j.neunet.2019.08.025 |
| [16] |
Lin TY, Goyal P, Girshick R, et al. Focal loss for dense object detection. Proceedings of 2017 IEEE International Conference on Computer Vision. Venice: IEEE, 2017. 2999–3007.
|
| [17] |
Szegedy C, Vanhoucke V, Ioffe S, et al. Rethinking the inception architecture for computer vision. Proceedings of 2016 IEEE Conference on Computer Vision and Pattern Recognition. Las Vegas: IEEE, 2016. 2818–2826.
|
| [18] |
He KM, Zhang XY, Ren SQ, et al. Deep residual learning for image recognition. Proceedings of 2016 IEEE Conference on Computer Vision and Pattern Recognition. Las Vegas: IEEE, 2016. 770–778.
|
| [19] |
Yu F, Koltun V. Multi-scale context aggregation by dilated convolutions. arXiv:1511.07122, 2016.
|
| [20] |
Chen LC, Papandreou G, Kokkinos I, et al. DeepLab: Semantic image segmentation with deep convolutional nets, atrous convolution, and fully connected CRFs. IEEE Transactions on Pattern Analysis and Machine Intelligence, 2018, 40(4): 834-848. DOI:10.1109/TPAMI.2017.2699184 |
| [21] |
Wang PQ, Chen PF, Yuan Y, et al. Understanding convolution for semantic segmentation. Proceedings of 2018 IEEE Winter Conference on Applications of Computer Vision. Lake Tahoe: IEEE, 2018. 1451–1460.
|
| [22] |
Ni ZL, Bian GB, Zhou XH, et al. RAUNet: Residual attention U-Net for semantic segmentation of cataract surgical instruments. Proceedings of the 26th International Conference on Neural Information Processing. Sydney: Springer, 2019. 139–149.
|
| [23] |
Codella NCF, Gutman D, Celebi ME, et al. Skin lesion analysis toward melanoma detection: A challenge at the 2017 international symposium on biomedical imaging (ISBI), hosted by the international skin imaging collaboration (ISIC). Proceedings of the 15th IEEE International Symposium on Biomedical Imaging. Washington, DC: IEEE. 2018. 168–172.
|
| [24] |
Tschandl P, Rosendahl C, Kittler H. The HAM10000 dataset, a large collection of multi-source dermatoscopic images of common pigmented skin lesions. Scientific Data, 2018, 5: 180161. DOI:10.1038/sdata.2018.161 |
| [25] |
Zhou ZW, Siddiquee MR, Tajbakhsh N, et al. UNet++: Redesigning skip connections to exploit multiscale features in image segmentation. IEEE Transactions on Medical Imaging, 2020, 39(6): 1856-1867. DOI:10.1109/TMI.2019.2959609 |
 2023, Vol. 32
2023, Vol. 32


