2. 广东邮电职业技术学院 计算机学院, 广州 510630
2. School of Computer, Guangdong Vocational College of Post and Telecom, Guangzhou 510630, China
目前, 我国农业技术发展存在不平衡不充分的现象, 农作物工作者主要通过肉眼目视病害叶片的方式, 来观察农作物病害情况. 然而, 由于植物病害种类繁多, 农作物工作者存在相关知识储备和农业病害防治能力不足的问题, 在缺乏相关技术指导的情况下容易导致对植物病害的误诊. 因此, 及时识别农作物病害类型是防治农作物病害、减少损失的关键. 近年来伴随着物联网技术、人工智能技术的蓬勃发展, 人工智能技术也被运用到植物病害检测中. 例如, 史红栩等[1]提出了一种香蕉远程病害诊断的解决方案, 针对香蕉作物常见的7种病害类型. 通过利用迁移学习对GoogLeNet进行训练来获取新的模型, 并在此基础上开发了服务器和APP, 进一步降低深度学习在植物病害检测领域的使用门槛. 乔虹[2]设计了一种基于深度学习的葡萄叶片病害动态监测系统, 该系统由动态监测和疾病诊断两个部分组成. 通过Faster R-CNN算法对监控视频进行逐帧处理, 借助卡尔曼滤波算法对葡萄叶片进行动态跟踪, 从而提取葡萄叶片的目标图像. 再通过对目标图像进行全局和局部特征显著性检测, 实现了对葡萄叶片病害类型诊断.
Fang等[3]指出的植物病害检测和鉴别的方法, 可以通过直接和间接方法来实现. 病害的直接检测包括了分子和血清学方法, 但是需要选取大量样本用于高通量分析. 在这些方法中, 直接检测引起疾病的病原体, 如细菌、真菌和病毒, 用于提供准确的疾病/病原体的鉴别. 常用的检测做法有PCR检测技术、酶联免疫吸附实验技术等. 另一方面, 间接方法是通过植株的形态变化、温度变化、蒸腾速率变化和挥发性有机化合物的释放量等参数来识别病害, 常用的检测方法有高光谱检测技术、荧光成像技术, 然后通过计算机图像分析辅助工作人员完成病害的检测. Cséfalvay等[4]提出了一种基于叶绿素荧光(Chl-F)成像技术的检测方法, 探讨该方法是否可用于揭示葡萄霜霉病感染的早期阶段, 从而改进杀虫剂的治疗效果. Oppenheim等[5]通过PlantVillage项目公开提供的14种作物的26种疾病状况的54 306张图像, 借助深度学习方法研究探讨了卷积神经网络模型在植物病害检测中的可行性. 同时对比分析了AlexNet[6]和GoogLeNet[7]的准确度和优劣性, 探讨了将深度学习技术迁移至移动端设备上的可能性和便捷性. Gajjar等[8]提出了一种基于嵌入式设备的植物叶片病害实时检测系统, 通过借助英伟达的Jetson TX1深度学习设备进行部署, 从而做到了文献[5]中提出将深度学习迁移至移动端设备的想法.
综上所述, 通过深度学习, 从输入数据中提取和识别特征, 可以进一步实现植物叶片病害的有效检测和识别. 然而, 由于实际检测的环境复杂, 且深度学习对硬件性能要求较高, 对现场图像进行实时检测的研究并不多, 大多数局限于实验室环境下, 以上的研究仍存在不足. 本研究基于OpenCV实现了植物叶片病害检测系统的设计, 并将系统部署到Jetson Nano计算平台, 利用高清摄像头持续捕抓病害叶片的视频流, 再实时对视频流逐帧进行植物叶片病害检测, 预测结果直接显示在屏幕. 使用SSD叶片目标检测模型与植物叶片病害分类模型相结合的识别方式, 大大提高了实时植物叶片病害检测的精确度. 并且对训练完成的ResNet深度网络进行TensorRT优化, 提高了植物叶片病害识别的速率, 使得嵌入式系统边缘计算设备实现实时检测植物叶片病害成为可能.
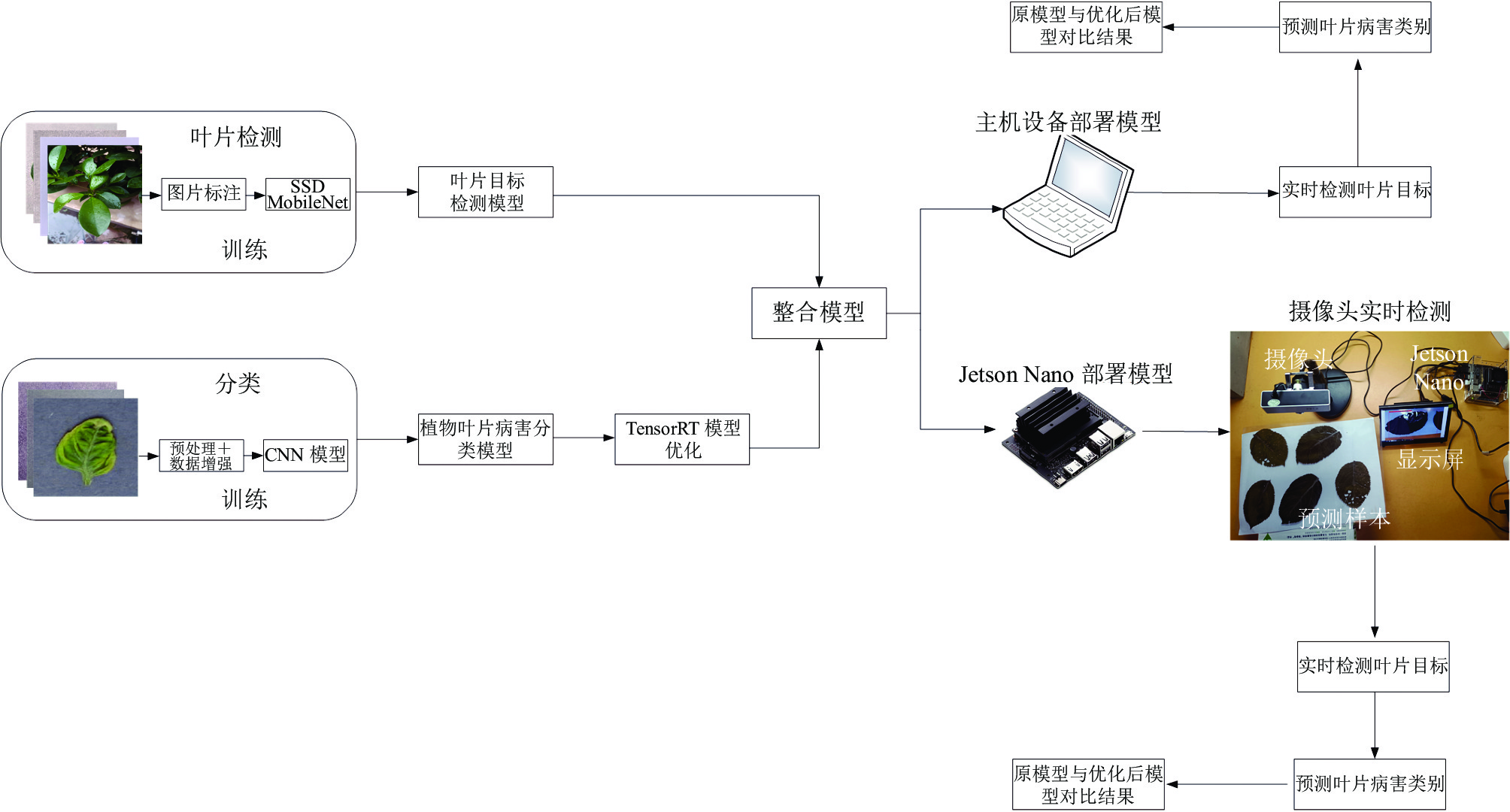
1 植物病害实时检测系统实现流程本研究的植物病害实时检测流程如图1所示, 首先利用MobileNet-V2训练植物叶片目标检测模型, 其次利用ResNet-152深度网络训练植物叶片病害分类模型. 通过OpenCV对植物叶片目标检测模型和植物叶片病害分类模型整合成植物叶片病害检测系统, 然后对优化模型前与优化模型后的植物叶片病害检测系统部署在主机设备和Jetson Nano设备上进行实验比较, 通过实验结果可以进一步分析模型优化前后的情况.
2 材料与方法 2.1 植物叶片目标检测模型的数据集为了保证训练出来模型的鲁棒性和健壮性, 增加数据的自发性. 本实验的训练数据集样本来源多个数据集库. 植物叶片检测模型数据来源:自建植物叶片数据集、加州大学欧文分校机器学习库、Mendeley数据集库. 在自建数据集中通过高清摄像机拍摄植物叶片图像作为采集的训练和测试样本, 数据集采集样本时间段为下午2点和6点. 训练植物叶片目标检测模型的样本选择了包含不同大小、颜色和种类的叶片, 保证了图像在光照、大小、聚类数量以及各种特征上都具有随机背景和亮度的变化, 除了考虑植物病害叶片之外, 还注重考虑正常植物叶片的数量. 叶片目标检测模型数据集来源具体如表1所示.
实验部分数据集样本图像如图2所示, 图2(a)和图2(b)是高清摄像机在下午2点拍摄; 图2(c)和图2(d)是摄像机于下午6点拍摄; 图2(e)是网络收集的实验样本; 图2(f)是加州大学欧文分校机器学习库(Folio data set)的实验样本. 图2(g)是Mendeley_data数据集库中Leaf Images 数据集的实验样本. 图2(h)是本研究训练植物叶片病害分类模型的数据集的实验样本.
|
图 1 植物叶片病害检测实验流程 |
| 表 1 叶片目标检测模型数据集来源 |

|
图 2 部分叶片检测模型数据集及样本叶片标注 |
2.2 LabelImg对目标检测数据集标注
目标检测模型训练需要添加带有叶片坐标信息的XML文件, 即需要对含有叶子的图像区域进行人工标注. 在标注过程中, 用边界框标记叶子的类和区域. 使用LabelImg工具在叶子上绘制边界框, 并且标注为 目标参数为Leaves类型, 生成包含每个图像中所有边界框各自坐标的XML文件. 数据集中经过标注的部分样本图像如图2(i)、图2(j)、图2(k)、图2(l)所示. 在标注过程中, 舍弃了一些像素不佳、叶片形态不明显的叶片图像, 最终对剩下的794张叶片图像进行了标注.
2.3 MobileNet-V2的SSD叶片目标检测模型SSD算法最先在VGG-16 基础架构下实现了准确与快速地检测以及跟踪视频流. 原VGG-16网络只包含了两层原始的卷积层. 而SSD算法改造后的VGG-16网络, 增加了4个卷积部分. 如图3所示.
通过增加卷积部分, 使SSD网络对输入的图片进行特征提取, 提取出38×38×512、19×19×1024、10×10×512、5×5×256、3×3×256、1×1×256这6个特征层. 特征层对输入的图像分割成不同数量的网格, 利用网格实现目标检测, 从而得到所需要的目标对象. SSD目标检测算法的实现除了VGG-16外还有多种提取特征的网络. 鉴于MobileNet网络拥有体积较小, 计算量可观的优点, 并且部署在嵌入式设备具有一定的速度优势[12], 因此本研究的SSD目标检测算法, 基于MobileNet-V2网络实现目标检测.

|
图 3 基于VGG-16的SSD主干网络结构 |
在实现基于MobileNet-V2的SSD叶片目标检测模型之前, 需要对数据集进行一定比例的划分, 训练集与验证集的比例为9:1, 训练集与验证集的总数量和测试集比例为9:1, 则训练集为642张、验证集为72张、测试集为80张. 目标检测模型调用了GPU进行训练, 达到提高模型训练速度的目的. 训练前需要建立类别对应的txt文件, 由于目标检测模型只有植物叶片一种类别, 则使用txt文件leaves标签. 在设定输入数据集的图片大小都调整为512×512尺寸. 此外, 选择相应的MobileNet-V2的权重参数模型, 对SSD植物叶片目标检测模型进行迁移学习. 本实验训练植物叶片目标检测的过程分成冻结训练和解冻训练两个阶段: 第1个阶段使用权重参数进行训练, 该阶段在设置目标检测模型的主干参数保持不变, 仅对网络进行微调.训练进行50次迭代, 鉴于硬件的性能, 批处理batch_size的大小只设置为8. 第2个阶段训练迭代的次数设置50次. 模型的主干会在训练过程中发生变化, 并且会引起特征提取网络改变. 此阶段对显卡显存有较大占用, 为了保证训练过程的持续进行, 把批处理batch_size的值设置为4. 植物叶片目标检测模型训练结束后, 则使用测试集图像通过SSD叶片目标检测模型进行预测. 将模型参数Confidence置信率设置为0.45, 非极大抑制所用到的Nms_iou大小设置为0.45, 结果如图4和图5所示, SSD叶片目标检测模型不仅能够以较高的置信率识别到单个病害叶片, 即使在比较光亮的环境仍然可以检测到叶片. SSD叶片目标检测模型对于密集叶片中也可以检测出清晰的叶片. 在复杂环境检测中, 依然能够保持精准的目标检测.

|
图 4 单叶片使用SSD叶片目标检测模型检测 |

|
图 5 多叶片使用SSD叶片目标检测模型检测 |
2.4 ResNet-152的植物叶片病害分类模型
Geetharamani等[10]公开了有 38种不同类别的植物叶片和一系列背景图像, 此数据集使用了多种图像增强技术来增加数据集的数量, 并使用增强数据的方式提高模型的分类能力. 本研究在此增强数据集的基础上, 挑选了苹果、樱桃、玉米、葡萄、桃子、灯笼椒、土豆、草莓、西红柿9种农业中常见的农作物叶片的33种健康或病害类型进行模型分类训练. 选择上述9种农作物是在农业大量培植并供人食用或做工业原料的农作物, 也建立了完整的病害叶片类型的防治图库, 同时是目前在生活中常被人们食用的食物. 本实验选择的此9种农作物作为植物叶片病害分类模型训练的数据集, 目的是提升植物叶片病害检测系统的实用价值. 本研究对数据集中33种健康和病害类型进行了大量的资料查证, 收集到数据集中每个标签对应叶片具体病害类型. 在训练分类模型之前, 需要对数据集进行划分. 植物叶片病害的训练集有36699张, 验证集有9145张, 每一种叶片病害的类型按照8:2的比例划分为训练集与验证集. 植物叶片图片预处理之后, 通过迁移学习方法构建和训练植物叶片病害分类模型.
本系统使用Torchvision库中的ResNet-152神经网络实现模型的预训练, 采用已有模型的权重与偏置参数作为模型训练时初始化的参数. 通过20次迭代的训练后, 得到的最优叶片病害分类模型经过验证集测试后的精确度达到了95%, 模型在训练集和验证集迭代后的损失率和准确率变化如图6所示.
2.5 OpenCV对目标检测模型与分类模型整合本研究合理调度了SSD植物叶片目标检测模型和植物叶片分类模型来完成对输入图像的植物叶片病害分类. 并且结合了OpenCV对视频流进行实时的叶片病害识别. 植物叶片病害检测系统运行流程如图7.
3 植物叶片病害分类模型的TensorRT优化TensorRT运用于深度学习推理优化器, 能够给深度学习的应用带来少延时、高吞吐量的部署推理. 基于英伟达的TensorRT应用程式, 在推理过程中的运行速率比纯CPU平台要高效. TensorRT 支持PyTorch框架, 同时提供了Python的接口程序, 主要用来针对英伟达设计的GPU进行推理加速. 本研究采用TensorRT对PyTorch的Pth模型的推理加速. 通过降低少量识别精度为代价, 提高模型整体的检测效率, 达到植物病害实时检测的效果.
TensorRT模型优化方式, 将模型神经网络的张量降为FP16或INT8的位数. 为了更好实现部署, 推理的过程中不需要反向传播, 从而减少模型神经网络的张量精度对模型造成大影响情况的发生. INT8只有8个位数, 仅表示256个数值范围, 若FP32精度的模型转换成INT8精度的模型, 会丢失大量精度信息, 造成模型预测性能大幅下降. 因此, 为了保证模型性能的损失降到最小化, 需要将分类模型的神经网络的张量精度转为FP16.
PyTorch模型经过TensorRT优化后生成的分类器, 被英伟达官方命名为引擎. 本研究对TensorRT优化的过程是基于ResNet的PyTorch模型先转换为ONNX模型再将其导入到TensorRT中生成高性能引擎, 并将引擎从磁盘加载到内存中继续使用它进行推理. 生成的引擎可转换成Trt格式并将其存储在磁盘上以供以后运行. 上述的优化流程称为序列化引擎. 将引擎从磁盘加载到内存中并继续使用它进行推理时, 就会发生反序列化. 如图8展示了引擎序列化和引擎反序列化的流程.

|
图 6 准确率和损失率变化图 |

|
图 7 植物叶片病害检测系统运行流程 |

|
图 8 引擎序列化和引擎反序列化流程 |
4 模型优化前后对比实验
本研究对PyTorch框架下调用植物病害分类模型与经过优化后的TensorRT引擎进行对比实验, 观察TensorRT引擎对于分类模型识别速度的提升效果. 再将优化前后模型分别结合SSD叶片目标检测模型对视频流进行实时的植物叶片病害检测, 观察TensorRT优化后对系统的整体检测速度提升效果. 为了保证实验的一致性, 对比实验在同一台主机上进行, 并且均使用GPU加载模型进行预测, 同时使用相同的验证数据集进行测试. 对比实验随机挑选验证集中的一张健康苹果(Apple_healthy)实验样本的图片数据进行预测, 对PyTorch框架下调用植物病害分类模型与经过优化后的TensorRT引擎的识别速度进行比较, 实验结果如表2所示. 可见两个模型都识别出来正确的类型, 虽然模型经TensorRT优化后, 其精度有所下降, 但是仅有0.2%的幅度, 影响微乎其微. 而识别速度却有质的提升, TensorRT引擎相比于PyTorch模型的识别速度提升了22倍.
| 表 2 PyTorch模型与TensorRT引擎对比 |
本实验还使用通过植物叶片病害检测系统调用优化前后的植物病害分类模型对视频流进行实时病害检测的对比实验. 实验的设计思路是在同一主机设备下调用摄像头分别对验证集中的同一样本叶片类型进行实时病害的识别检测, 分别观察优化前后的两个模型结合SSD叶片目标检测模型对样本叶片的检测速度和叶片识别的准确性. 实验挑选了灯笼椒辣椒疮痂病(Pepper, _Bell_Bacterial_Spot)病害类型的一个样本进行测试. 为观察检测速度的快慢, 引进帧率进行衡量, 帧率即每秒帧数, 简称FPS, 1 s内可以处理的帧数越多, 则处理的图像就越多, FPS就会越高, 屏幕上的显示就越流畅. 较低的帧速率会显得卡顿或检测的延迟较高, 使用帧率是评估模型性能和识别速度的重要指标. 图9显示了在同一主机设备上未经优化的PyTorch分类模型与经过优化的TensorRT引擎在结合SSD叶片目标检测模型进行实时的植物叶片病害检测时识别速率的对比, 图9(a)和图9(b)显示的是未经过优化的PyTorch分类模型在结合SSD叶片目标检测模型的识别速率的表现, 可见实时检测装置没有检测到叶片时, 识别的速率是在18 FPS左右浮动, 而识别到叶片后, 在成功识别到正确病害类型的情况下, 仅有1.28 FPS的速率. 而从图9(c)和图9(d)展示的经过优化的Tensor-RT引擎结合SSD叶片目标检测模型的识别速率来看, 在没有识别到叶片的存在时, 其识别的速率有17 FPS左右, 与未经过优化的PyTorch分类模型在结合SSD叶片目标检测模型的识别速率在相同情况下不相上下. 在识别到叶片后, 依旧可以成功识别到正确病害类型, 识别的速率为9.71 FPS左右, 帧率比未经过优化的PyTorch分类模型在同等情况下相比提高了7倍, 同时在实验过程中植物叶片病害检测系统运行流畅. 因此, 经过优化的TensorRT引擎对系统的识别速率提升幅度十分明显. 而TensorRT引擎的加速效果在Jetson Nano计算平台上有更加明显的体现, 如图10所示. 图10(a)和图10(c)表示在没有识别到叶片的存在时, 优化前后植物叶片病害检测系统在Jetson Nano上运行时, 识别的帧率都有3.6 FPS左右, 而在对叶片的类型进行检测时, 未经优化的植物叶片病害检测系统在Jetson Nano的识别的帧率仅有0.21 FPS, 如图10(b)所示. 经过优化的植物叶片病害检测系统在Jetson Nano的识别的帧率达到了2.11 FPS, 提升了10倍的帧率, 如图10(d)所示. 由此可知, 优化后的植物叶片病害检测系统在Jetson Nano计算平台上达到实时检测叶片病害的效果.

|
图 9 主机设备上的模型优化对系统提升对比结果 |

|
图 10 Jetson Nano上的模型优化对系统提升对比结果 |
5 结论与展望
本研究首先通过迁移学习的机器学习方法构建了叶片目标检测模型和植物叶片病害分类模型, 并通过OpenCV对两个模型进行整合, 完成植物叶片病害检测系统的实现. 为了再实现系统的实时检测, 对植物叶片病害分类模型进行了TensorRT优化, 并且对模型优化前后进行对比实验. 实验表明, 在同一主机设备上, 优化后的植物叶片病害分类模型对叶片类型的识别速度相较于优化前提升了22倍, 植物叶片病害检测系统的识别帧率相较于优化前提升了7倍, 而在Jetson Nano计算平台运行植物叶片病害检测系统的识别帧率相较于优化前也提升了10倍, 达到了边缘计算设备进行实时检测的标准, 从而使采用廉价的硬件设备来实现实时植物叶片病害检测成为可能. 在未来的研究中, 我们将继续展开植物叶片病害实时检测系统在Jetson Nano计算平台上的优化实验, 使实时检测系统在面向复杂的环境中具备高效率的植物叶片病害识别.
| [1] |
史红栩, 李修华, 李民赞, 等. 基于深度学习的香蕉病害远程诊断系统. 华南农业大学学报, 2020, 41(6): 92-99. DOI:10.7671/j.issn.1001-411X.202004027 |
| [2] |
乔虹. 基于深度学习的葡萄叶片病害动态监测[硕士学位论文]. 兰州: 甘肃农业大学, 2019.
|
| [3] |
Fang Y, Ramasamy RP. Current and prospective methods for plant disease detection. Biosensors, 2015, 5(3): 537-561. DOI:10.3390/bios5030537 |
| [4] |
Cséfalvay L, Di Gaspero G, Matouš K, et al. Pre-symptomatic detection of Plasmopara viticola infection in grapevine leaves using chlorophyll fluorescence imaging
. European Journal of Plant Pathology, 2009, 125(2): 291-302. DOI:10.1007/s10658-009-9482-7 |
| [5] |
Oppenheim D, Shani G, Erlich O, et al. Using deep learning for image-based potato tuber disease detection. Phytopathology, 2019, 109(6): 1083-1087. DOI:10.1094/PHYTO-08-18-0288-R |
| [6] |
Krizhevsky A, Sutskever I, Hinton GE. ImageNet classification with deep convolutional neural networks. Proceedings of the 25th International Conference on Neural Information Processing Systems. Lake Tahoe: Curran Associates Inc., 2012. 1097–1105.
|
| [7] |
Szegedy C, Vanhoucke V, Ioffe S, et al. Rethinking the inception architecture for computer vision. Proceedings of the IEEE Conference on Computer Vision and Pattern Recognition. Las Vegas: IEEE, 2016. 2818–2826.
|
| [8] |
Gajjar R, Gajjar N, Thakor VJ, et al. Real-time detection and identification of plant leaf diseases using convolutional neural networks on an embedded platform. The Visual Computer, 2022, 38(8): 2923-2938. DOI:10.1007/s00371-021-02164-9 |
| [9] |
Asuncion A, Newman DJ. UCI machine learning repository. Technical Report, Irvine: Irvine University of California, 2007.
|
| [10] |
Geetharamani G, Arun Pandian J. Identification of plant leaf diseases using a nine-layer deep convolutional neural network. Computers & Electrical Engineering, 2019, 76: 323-338. |
| [11] |
Siddharth SC, Singh UP, Kaul A, et al. A database of leaf images: Practice towards plant conservation with plant pathology. Mendeley Data, 2019, V4.
|
| [12] |
Howard AG, Zhu ML, Chen B, et al. MobileNets: Efficient convolutional neural networks for mobile vision applications. arXiv:1704.04861, 2017.
|
 2023, Vol. 32
2023, Vol. 32


